

深圳医疗器械展会、深圳国际医疗器械博览会、深圳医博会、深圳国际医疗器械展览会、深圳医疗器械展览会、深圳医疗器械展、深圳医疗展、深圳医疗展会、深圳医疗器械展览会、深圳医疗器械展会、深圳医疗器械展、深圳医疗展、医疗器械展览会、医博会、医疗器械展、医疗器械展会、医疗器械展览会、2021年医疗器械展会、中国医疗器械展会、医疗器械博览会、中国国际医疗器械博览会
关注更多医疗器械展会咨询http://www.szmedexpo.com
来源: 奥咨达医疗技术服务 作者: 奥咨达 2021年10月18日 17:52
2021年10月18号,欧盟IVDR法规(也即 (EU) 2017/746)宣布修正法规第110条(Article 110)Transitional provisions,延长IVDR过渡期。此举彻底坐实了此前呼之欲出的多次吹风,让一直悬而未定的猜测变成现实。

需要明确的是:IVDR法规生效的时间仍然是2022年5月26日,生效时间没有延后!
延期理由显而易见。新旧法规的差异,导致市场上约80%的IVD产品的合规途径由“自我符合性声明”变为需要公告机构审查。但目前仅有6家新规指定的公告机构,再加上COVID-19的冲击,公告机构的审核能力严重短缺,实在是无法满足市场需求。贸然依照原计划执行,恐怕将造成市场上大量IVD产品供应中断。
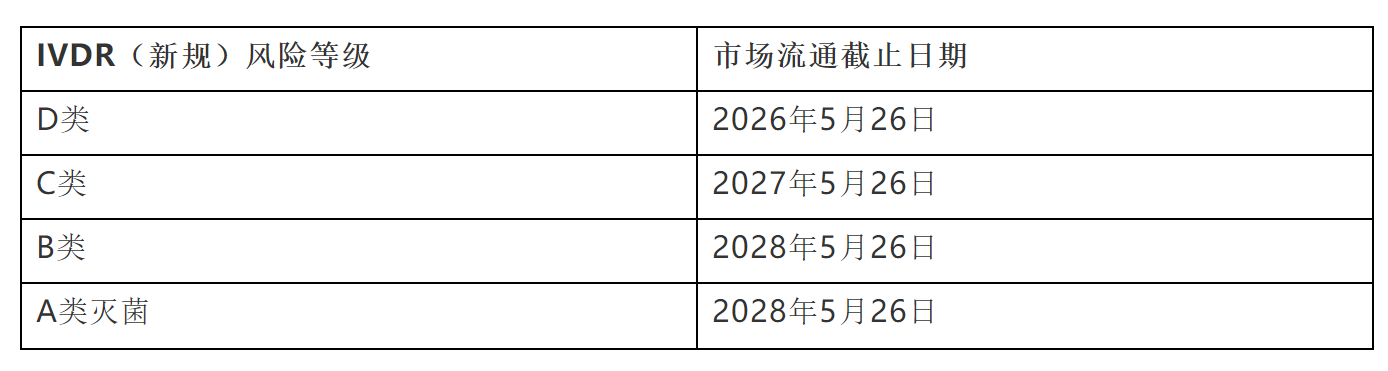
为了防止IVD产品供应短缺或者延误,有必要延长IVDR中规定的IVDD证书所覆盖器械的过渡期。过渡期的长短应取决于相关器械的风险等级,对于高风险器械的过渡期较短,而低风险器械的过渡期较长。具体内容如下:

值得注意的是,对于在IVDR法规下,属于“自我符合性声明”注册路径的class A非灭菌产品,则仍然需要在2022年5月26日前完成新旧法规的转换。
另,对于2022年5月26日前取得IVDD证书的EC产品验证(EC VERIFICATION)路径下认证的产品,市场流通截止日期如下:
最后,IVDD属于others类,但是IVDR属于高风险的产品,建议赶在2022年5月26日前尽早进行IVDD“自我符合性声明”认证,这样产品可以在欧盟继续合法销售至少3年。
否则,就是属于“new device”,在2022年5月26日之后,需要按照IVDR取得证书才可销售。
有这类产品的企业,尽快行动起来啦!!
本文著作权属原创者所有,不代表本站立场。我们转载此文出于传播更多资讯之目的,如涉著作权事宜请联系删除。